น้ำเดือดที่ 100 ° C และอุณหภูมิจะไม่เพิ่มขึ้นแม้ว่าจะมีการให้ความร้อนกับมัน เมื่อเทียบกับอัตราการระเหยขึ้นอยู่กับพื้นที่ผิวในแง่ที่ว่าพื้นที่ขนาดใหญ่กว่าที่เร็วกว่าจะเป็นกระบวนการ ลองมาดูบทความด้านล่างซึ่งช่วยลดความแตกต่างระหว่างการเดือดและการระเหย
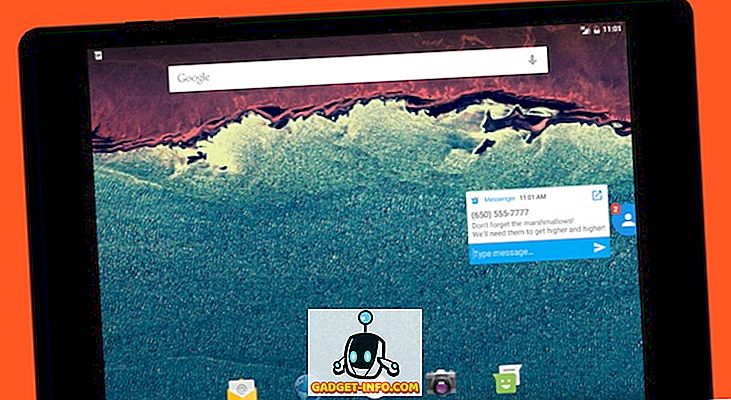
แผนภูมิเปรียบเทียบ
| พื้นฐานสำหรับการเปรียบเทียบ | การต้ม | การระเหย |
|---|---|---|
| ความหมาย | การต้มหมายถึงกระบวนการกลายเป็นไอที่เปลี่ยนของเหลวเป็นก๊าซเมื่อได้รับความร้อนอย่างต่อเนื่อง | การระเหยเป็นกระบวนการทางธรรมชาติซึ่งของเหลวเปลี่ยนรูปแบบเป็นแก๊สเนื่องจากการเพิ่มขึ้นของอุณหภูมิหรือความดัน |
| ปรากฏการณ์ | ขนาดใหญ่ | พื้นผิว |
| อุณหภูมิที่ต้องการ | เกิดขึ้นที่จุดเดือดเท่านั้น | เกิดขึ้นที่อุณหภูมิใด ๆ |
| ฟองฟอด | มันก่อตัวเป็นฟอง | มันไม่ก่อให้เกิดฟอง |
| พลังงาน | ต้องการแหล่งพลังงาน | พลังงานถูกจัดหาโดยรอบ |
| อุณหภูมิของของเหลว | ยังคงคงที่ | ลด |
ความหมายของการต้ม
การต้มเป็นการเปลี่ยนแปลงทางกายภาพและการกลายเป็นไออย่างรวดเร็วซึ่งของเหลวจะถูกเปลี่ยนเป็นไอเมื่อมีการให้ความร้อนอย่างต่อเนื่องที่อุณหภูมิซึ่งความดันไอของของเหลวนั้นเหมือนกับแรงดันภายนอกที่กระทำโดยรอบ
อุณหภูมิที่จุดเดือดเริ่มเป็นที่รู้จักกันในชื่อจุดเดือด มันขึ้นอยู่กับความดันที่กระทำกับของเหลวเช่นยิ่งความดันมากขึ้นสูงขึ้นจะเป็นจุดเดือด ในกระบวนการเดือดเมื่อโมเลกุลของสารกระจายตัวจนสามารถเปลี่ยนสถานะได้ฟองจะเกิดขึ้นและเริ่มเดือด
ในกระบวนการนี้เมื่อเราให้ความร้อนของเหลวความดันไอจะเพิ่มขึ้นจนกระทั่งเท่ากับความดันบรรยากาศ หลังจากนั้นการก่อตัวของฟองจะเกิดขึ้นภายในของเหลวและย้ายไปที่พื้นผิวและระเบิดที่เกิดขึ้นในการปล่อยก๊าซ แม้ว่าเราจะเพิ่มความร้อนให้กับของเหลวมากขึ้นอุณหภูมิการต้มก็จะเท่าเดิม
คำจำกัดความของการระเหย
กระบวนการที่องค์ประกอบหรือสารประกอบถูกแปลงจากสถานะของเหลวเป็นสถานะก๊าซเนื่องจากการเพิ่มขึ้นของอุณหภูมิและ / หรือความดันเป็นที่รู้จักกันในชื่อการระเหย กระบวนการนี้สามารถใช้เพื่อแยกของแข็งที่ละลายในของเหลวเช่นเกลือที่ละลายในน้ำ มันเป็นปรากฏการณ์พื้นผิวนั่นคือมันเกิดขึ้นจากพื้นผิวของของเหลวเป็นไอ
พลังงานความร้อนเป็นความต้องการขั้นพื้นฐานสำหรับการระเหยที่เกิดขึ้นคือการแยกพันธะที่ยึดโมเลกุลของน้ำเข้าด้วยกัน ด้วยวิธีนี้จะช่วยให้น้ำระเหยช้าลง ณ จุดเยือกแข็ง
การระเหยส่วนใหญ่ขึ้นอยู่กับอุณหภูมิและปริมาณน้ำที่มีอยู่ในแหล่งน้ำกล่าวคือยิ่งอุณหภูมิสูงขึ้นและยิ่งมีน้ำมากเท่าไรอัตราการระเหยจะสูงขึ้น กระบวนการสามารถเกิดขึ้นได้ทั้งในสภาพแวดล้อมทางธรรมชาติและที่มนุษย์สร้างขึ้น
ความแตกต่างที่สำคัญระหว่างการต้มและการระเหย
จุดที่ระบุด้านล่างมีความสำคัญเนื่องจากอธิบายความแตกต่างระหว่างการเดือดและการระเหย:
- การต้มหมายถึงกระบวนการระเหยกลายเป็นสถานะก๊าซที่สถานะจุดเดือดที่แน่นอน ในทางตรงกันข้ามการระเหยถูกกำหนดให้เป็นกระบวนการทางธรรมชาติซึ่งการเพิ่มขึ้นของอุณหภูมิและ / หรือความดันเปลี่ยนของเหลวเป็นก๊าซ
- การต้มเป็นปรากฏการณ์จำนวนมากในแง่ที่ว่ามันเกิดขึ้นทั่วทั้งของเหลว ในทางกลับกันการระเหยเป็นปรากฏการณ์ที่เกิดขึ้นบนพื้นผิวของของเหลว
- การต้มของเหลวเกิดขึ้นเฉพาะที่จุดเดือดของของเหลวนั่นคือเกิดขึ้นที่อุณหภูมิแน่นอนเท่านั้น กระบวนการระเหยสามารถเกิดขึ้นได้ทุกอุณหภูมิ
- ในการต้มฟองจะเกิดขึ้นภายในของเหลวจากนั้นก็จะเคลื่อนขึ้นและแตกออกเป็นก๊าซในขณะที่ไม่มีฟองเกิดขึ้นในกระบวนการระเหย
- ในขณะที่ต้องการแหล่งพลังงานในกระบวนการเดือด แต่พลังงานจากการระเหยนั้นถูกล้อมรอบ
- ในการต้มอุณหภูมิของของเหลวจะยังคงเหมือนเดิมในขณะที่ในกรณีที่การระเหยของอุณหภูมิของของเหลวนั้นมีแนวโน้มลดลง
ข้อสรุป
ในการสรุปการต้มเป็นกระบวนการที่เร็วกว่าเมื่อเทียบกับการระเหยในขณะที่โมเลกุลของของเหลวเคลื่อนที่เร็วกว่าการเดือดกว่าในกระบวนการระเหย ในขณะที่เดือดผลิตความร้อนและไม่ก่อให้เกิดความเย็นของของเหลวการระเหยนำไปสู่